Myélopathie cervicarthrosique
Définition
La myélopathie cervicarthrosique est l’équivalent à l’étage cervical de la sténose canalaire lombaire. C’est une affection d’origine dégénérative, survenant le plus souvent chez le sujet âgé ou d’âge mûr, le plus souvent après 50 ans.
Comme dans la sténose canalaire lombaire, les modifications anatomiques générées par l’arthrose entrainent une réduction du calibre utile du canal rachidien cervical dans lequel cheminent la moelle épinière et les racines nerveuses destinées aux membres supérieurs. Ce rétrécissement canalaire a pour conséquence une compression progressive de ces différents éléments nerveux.
L’existence d’une étroitesse congénitale du canal cervical prédispose à la survenue d’une myélopathie cervicarthrosique.
En effet dans certaines ethnies, comme au Japon, la myélopathie cervicarthrosique peut-être favorisée par une ossification du ligament longitudinal dorsal qui, tapissant la face postérieure des corps vertébraux, forme la paroi antérieure du canal médullaire. L’épaississement de cette paroi va progressivement rétrécir le calibre du canal et entrainer une compression médullaire.
La myélopathie cervicarthrosique est donc l’ensemble des signes neurologiques (fonctionnels et cliniques) et radiologiques qui résultent de la compression de la moelle épinière par rétrécissement arthrosique du canal rachidien cervical.
Anatomie
L’arthrose entraîne un amincissement des cartilages et un affaissement des disques inter-vertébraux, avec pour conséquence un contact entre les surfaces osseuses et un épaississement réactionnel de l’os vertébral. La dégénérescence des articulations entraîne aussi un épaississement ligamentaire, notamment des ligaments jaunes, qui ferment le canal en arrière.
Ces modifications morphologiques au niveau des vertèbres, des disques, des articulations postérieures intervertébrales et des ligaments viennent empiéter sur l’espace intra-canalaire normalement réservé au fourreau dural, qui contient la moelle épinière, et aux racines nerveuses. Il s’ensuit naturellement une compression des ces éléments nerveux, aggravée par les mouvements répétés des vertèbres entre elles, très mobiles au niveau de la colonne vertébrale, qui entrainent un cisaillement chronique de la moelle épinière.
Schéma illustrant la diminution du calibre utile du canal rachidien en relation avec les altérations morphologiques des parois du canal liées à l’arthrose (protrusions discales, ostéophytes) et son retentissement sur le fourreau dural (liseré jaune) et la moelle épinière qu’il contient :
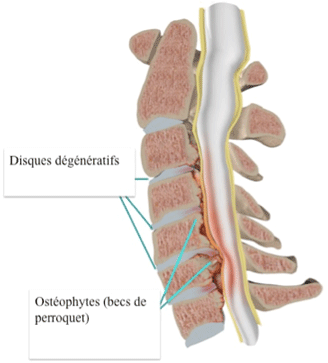
Diminution de calibre du canal rachidien
Schéma illustrant le cisaillement de la moelle épinière cervicale dans la myélopathie cervicarthrosique lors des mouvements de flexion et d’extension du rachis cervical :

Cisaillement de la moelle épinière
Symptomatologie clinique
L’atteinte de la moelle épinière au cours de la myélopathie cervicarthrosique est en général progressive, sur plusieurs mois ou années, à l’origine d’un handicap fonctionnel de plus en plus invalidant, associant à des degrés divers des troubles sensitifs et moteurs aux 4 membres, mais aussi des troubles sphinctériens (perte progressive du contrôle des urines et des matières fécales). Cette atteinte peut également être aggravée des manière brutale à l’occasion d’un traumatisme, direct ou indirect, de la moelle cervicale.
Les signes les plus fréquents sont :
- aux membres supérieurs : une perte de la sensibilité au niveau des doigts et des mains, des paresthésies (sensation d’engourdissement, de fourmillements), une perte progressive de la force musculaire avec difficultés à effectuer des gestes de la vie quotidienne comme se boutonner, se déboutonner, tourner une clé dans une serrure, ouvrir un bocal de confiture, visser, écrire…
- aux membres inférieurs : la sensation de marcher sur du coton, des paresthésies, des troubles de la marche avec, au début, une raideur des hanches et des genoux en rapport avec une hypertonie des muscles extenseurs, une difficulté qui apparaît d’abord au démarrage puis qui va progressivement diminuer le périmètre de marche.
L’évolution spontanée de la myélopathie cervicarthrosique se fait progressivement vers la paralysie irréversible des 4 membres. Un diagnostic et un traitement neurochirurgical précoces de cette maladie sont nécessaires pour en diminuer les séquelles neurologiques.
Examens complémentaires
Les examens d’imagerie
L’IRM
C’est l’examen de référence qui permet d’une part de montrer le rétrécissement arthrosique du canal rachidien et la compression médullaire qu’il entraîne, et d’autre part de mettre en évidence la souffrance de la moelle épinière (= myélopathie) en relation avec la compression médullaire. Cette souffrance de la moelle est matérialisée par une anomalie du signal en IRM qui est le reflet de l’œdème ischémique de la moelle. Par ailleurs, les reconstructions sagittales (vue de profil du canal rachidien) permettent de visualiser l’étendue en hauteur du rétrécissement canalaire et de la souffrance médullaire et par conséquent de quantifier précisément le nombre d’étages qu’il faudra décomprimer chirurgicalement.
Des séquences dynamiques peuvent également être demandées dans certains cas, permettant de mettre en évidence une compression positionnelle de la moelle.
Coupe sagittale d’IRM : la myélopathie apparaît sous la forme d’un hypersignal centro-médullaire (tâche claire au sein de la moelle épinière pointée par la flèche jaune) en regard du segment le plus rétréci du canal cervical (ici en C4C5, C5C6 et C6C7, entourés par le cercle rouge) :

Coupe sagittale d’IRM
Le scanner
Il montre très bien les altérations osseuses des vertèbres (ostéophytes) et l’amputation du calibre utile du canal qu’elles entraînent. La distinction entre compressions dures, d’origine ostéophytique, et compressions molles, d’origine disco-ligamentaire, est importante d’un point de vue chirurgical. C’est pourquoi un scanner complémetaire peut être prescrit par votre chirurgien avant l’intervention, alors même que le diagnostic a été confirmé par l’IRM.
Coupes axiales de scanner : montrant nettement la composante essentiellement ostéophytique de la compression ainsi que le rétrécissement du foramen intervertébral gauche (cercle rouge) :

Coupe axiale de scanner
Les radiographies standard
Elles sont surtout utiles, comme le scanner, en pré-opératoire. Leur intérêt principal est de dépister un trouble statique du rachis cervical, sous la forme d’une anomalie de courbure ou d’un spondylolisthésis (glissement d’une vertèbre par rapport à la vertèbre adjacente). Les clichés dynamiques sont également intéressants pour dépister une instabilité entre 2 vertèbres, parfois inaperçue sur les clichés statiques. Ces anomalies de la statique du rachis doivent absolument être prises en considération avant l’intervention car elles peuvent modifier la stratégie chirurgicale.
Cliché radiographique de profil montrant un antélisthésis de C3 sur C4 (matérialisé par les traits bleus, soulignant le décalage entre les murs postérieurs des 2 corps vertébraux – trait discontinu rouge) :
Autres examens
Un électromyogramme (EMG) peut parfois être demandé pour renforcer le diagnostic en étudiant le fonctionnement électrique des racines nerveuses.
Les examens biologiques ne sont en général d’aucune utilité pour le diagnostic de myélopathie cervicarthrosique.
En revanche, il arrive que le tableau clinique et radiologique évoque une pathologie neurologique autre, comme une sclérose latérale amyotrophique, une sclérose combinée de la moelle ou encore une sclérose en plaques. Dans ces cas-là, votre neurochirurgien vous adressera à un confrère neurologue pour d’éventuelles explorations complémentaires qui permettront d’en confirmer ou d’en écarter le diagnostic (potentiels évoqués, dosage de la vitamine B12, ponction lombaire pour analyse du liquide céphalo-rachidien,…)
Évolution spontanée
L’évolution de la myélopathie cervicarthrosique, en l’absence de traitement, est habituellement progressive sur plusieurs mois ou plusieurs années. Il peut y avoir des décompensations brutales à l’occasion d’un traumatisme direct ou indirect de la colonne cervicale (syndrome de Schneider).
L’évolution se fait en règle générale vers l’aggravation progressive mais inéluctable des troubles moteurs et sensitifs avec altération croissante de la marche, de la mobilité des membres supérieurs, et des fonctions sphinctériennes, conduisant petit à petit à la perte de l’autonomie.
Traitement
Le traitement médical
Il n’y a aucun traitement médical curatif de cette affection, qui résulte essentiellement d’un problème mécanique de compression de la moelle épinère. Tout au plus peut on proposer des traitements antalgiques pour diminuer les douleurs, et de la kinésithérapie pour ralentir l’aggravation du handicap fonctionnel.
Le seul traitement de cette maladie est chirurgical.
Le traitement chirurgical
Indication
Il est indiqué d’emblée dès l’établissement du diagnostic, de façon à prévenir l’apparition de lésions neurologiques irréversibles. Il est évidemment d’autant plus urgent que les symptômes sont sévères.
L’objectif est de redonner au canal vertébral des dimensions normales, pour que la moelle épinière et les racines nerveuses qui y cheminent ne soient plus comprimées, de manière à stopper l’évolution de la maladie et si possible faire régresser les symptômes, dans la mesure où il n’existe pas déjà des lésions neurologiques irréversibles.
Techniques
Plusieurs techniques de décompression médullaire existent. Le choix de la ou des techniques dépend de plusieurs paramètres : la prédominance motrice ou sensitive des symptômes (généralement en rapport avec une compression plutôt antérieure ou plutôt postérieure de la moelle épinière, respectivement), le nombre de niveaux vertébraux sténosés, l’origine de la compression (disco-ostéophytes antérieurs ou arthrose zygapophysaire postérieure), l’existence d’un trouble de la statique vertébrale (spondylolisthésis, cyphose cervicale), état général du patient.
Schématiquement, lorsque le rétrécissement du canal vertébral est très étendu en hauteur (plus de 3 segments mobiles rachidiens), on préfèrera une décompression postérieure par laminectomie ou laminoplastie, parfois associée à une fixation postérieure des vertèbres.
Une décompression par voie antérieure (dissectomie ou somatotomie médiane) sera préconisée en cas de compression provenant des disques intervertébraux, n’excédant pas 3 segments mobiles rachidiens, et en cas de troubles de la statique vertébrale. La décompression par voie antérieure est le plus souvent associée à une arthrodèse des vertèbres.
Dans certains cas, une décompression par voie antérieure et par voie postérieure est nécessaire, et généralement effectuée en 2 temps.
- La laminectomie : elle consiste, après avoir ouvert la peau au niveau de la nuque par une incision longitudinale médiane de 4 à 10 cm selon le nombre d’étages sténosés, à désinsérer et à écarter latéralement les masses musculaires paravertébrales. Ceci fait, le chirurgien ouvre le canal vertébral en enlevant les lames vertébrales et en réséquant le ligament jaune, qui est comme un rideau tendu d’une lame vertébrale à l’autre, fermant le canal rachidien en arrière, de part et d’autre de apophyse épineuse.

Laminectomie des vertèbres C3 à C7
IRM pré-opératoire (image de gauche) montrant une compression postérieure de la moelle en regard de C3 et C4 (cercle rouge) ; IRM post-opératoire (image de droite) après laminectomie de C3 à C6

Compression postérieure de la moelle en regard de C3 et C4
- La laminoplastie : l’abord est identique à la laminectomie mais la décompression de la moëlle est obtenue par ouverture unilatérale de l’arc postérieur, qui est basculé de l’autre côté. L’ouverture est maintenue par mise en place d’une petite plaque métallique vissée ou par interposition d’un petit greffon osseux. Cette technique est plus difficile et plus fastidieuse que la laminectomie mais permet de conserver les parois osseuses du canal vertébral sur lesquelles sont normalement insérés les muscles de la nuque.

Technique chirurgicale de la laminoplastie
- La technique mini-invasive (microchirurgie transtubulaire) : il s’agit d’une procédure microchirurgicale, c’est-à-dire réalisée sous contrôle microscopique.
La principale différence avec la technique ouverte réside dans la manière d’aborder le canal vertébral. En effet, l’approche mini-invasive utilise un système de tubes dilatateurs de diamètre croissant, introduits à travers une mini-incision cutanée unilatérale d’environ 3 à 4 cm, à travers le muscle paravertébral, jusqu’à mise en place d’un tube de travail de diamètre de 2 cm, et de longueur variable selon l’épaisseur de la nuque.
Le positionnement du tube est précis, guidé par un repérage radioscopique per-opératoire de profil. L’utilisation de tubes de diamètre croissant introduits à travers le muscle permet de repousser les fibres musculaires autour du tube de travail, sans les abîmer et surtout sans sectionner les insertions osseuses des muscles paravertébraux. Ce détail est important car la désinsertion musculaire a en général pour conséquence d’entraîner une dévascularisation musculaire, par sacrifice des petits vaisseaux irriguant le muscle et donc une atrophie du muscle paravertébral.
La décompression du canal est effectuée par un seul côté, en fraisant sous microscope la lame vertébrale puis les 2 ligaments jaunes. L’intérêt de cette technique pour le patient est triple :
1) tout d’abord esthétique car l’incision est beaucoup plus petite que dans la technique classique ;
2) ensuite et surtout il est fonctionnel car, par la préservation des muscles paravertébraux qu’elle permet, cette procédure est moins douloureuse et permet un lever le jour même et une reprise plus précoce des activités ;
3) enfin il est mécanique car la préservation des puissants muscles de la nuque, qui ont un rôle majeur dans la stabilité du rachis cervical, diminue le risque de déstabilisation post-opératoire ou de dégradation cyphotique de la colonne cervicale que l’on peut observer après des laminectomies très étendues.
Abord mini-invasif transtubulaire C5C6 droit : scanner de contrôle post-opératoire montrant l’élargissement obtenu du canal vertébral (1), l’ouverture du canal à travers les lames vertébrales (2) et aspect de la cicatrice cutanée aussitôt après l’intervention (3)
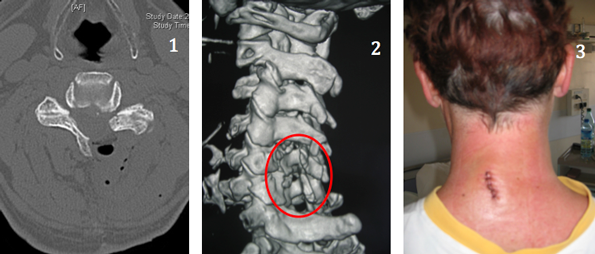
Abord mini-invasif transtubulaire
- La décompression médullaire par dissectomie mono- ou pluri-étagée : le rachis est abordé par cervicotomie antérieure, comme dans la chirurgie pour hernie discale cervicale (voir Névralgie cervico-brachiale). L’intervention consiste à décomprimer la moelle en enlevant le fragment de disque qui comprime la moelle ainsi que les ostéophytes adjacents, par microfraisage afin d’éviter tout traumatisme supplémentaire sur les éléments nerveux du canal. Le disque enlevé est ensuite remplacé par un implant synthétique permettant de maintenir la hauteur entre les 2 corps vertébraux et d’obtenir à terme une fusion osseuse. Cette procédure peut-être réalisée sur 1 à 3 niveaux adjacents.
- La décompression médullaire par somatotomie médiane : l’abord est le même que pour la dissectomie. La décompression de la moelle est obtenue en réalisant une tranchée médiane à travers le ou les corps vertébraux en regard desquels le canal est rétréci. Un greffon osseux prélevé au niveau du bassin (crête iliaque) est ensuite mis en place dans cette tranchée, stabilisé par une plaque métallique, vissée dans les corps vertébraux sus- et sous-jacents afin d’obtenir à terme une fusion osseuse.
Schémas d’une somatotomie médiane cervicale avec, de gauche à droite : (1) décompression de la moelle par fraisage d’une tranchée à travers les corps vertébraux, (2) arthrodèse par greffon osseux, (3) ostéosynthèse par plaque vissée.
Scanner pré-opératoire (images de gauche) et post-opératoire (image de droite) après décompression antérieure et postérieure par dissectomie pluri-étagée et laminoplastie.
Complications
Les complication de cette chirurgie sont heureusement rares. Il s’agit le plus souvent de l’hématome (< 1% des procédures), de l’infection (< 1%) et de la plaie de dure-mère ou brèche durale (< 5%), qui peut entrainer un fuite de liquide céphalo-rachidien avec ses conséquences propres (céphalées orthostatiques, c’est-à-dire en position debout, liées à la baisse de pression intra-crânienne, plus rarement méningite). Le risque d’hématome et surtout d’infection est plus faible en chirurgie mini-invasive.
L’hématome : il se manifeste par des troubles de la sensibilité ou de la motricité pouvant affecter les 4 membres. Cette complication survient en général dans les heures qui suivent l’intervention, certains cas surviennent de façon un peu différée (48h). Les facteurs de risque sont les troubles de la coagulation sanguine, les traitements anti-coagulants ou anti-agrégants plaquettaires quand ceux-ci ne peuvent être arrêtés avant l’intervention ou quand ils doivent être repris rapidement après. L’origine du saignement est soit veineuse épidurale, soit musculaire.
L’infection : Les facteurs de risque de l’infection sont le diabète mal équilibré, l’obésité, le tabagisme chronique, un défaut d’hygiène corporelle, des soins de cicatrice opératoire insuffisants. Le microbe plus souvent rencontré est le staphylocoque (soit le staphylococcus epidermidis, soit le staphylococcus aureus ou staphyocoque doré). Ces germes composent la flore bactérienne normale de la peau. La présence de ces germes autour du site opératoire est diminuée par les mesures d’asepsie avant et pendant l’intervention. La douche bétadinée la veille et le matin de l’intervention fait partie de ces mesures. La chirurgie en condition mini-invasive diminue le risque d’infection car l’intégralité de la procédure est réalisée à travers le tube de travail, ce qui permet d’éviter tout contact entre le plan cutané (la peau du patient) et les instruments qui pénètrent dans le corps du patient. 2 types d’infection peuvent survenir.
1) L’infection superficielle, sans gravité, qui intéresse le plan sous-cutané et la peau, et qui survient dans les jours qui suivent la chirurgie. Elle peut nécessiter une réintervention pour prélèvement bactériologique et lavage chirurgical de la plaie opératoire avant mise en route d’un traitement antibiotique d’une durée de 2 semaines.
2) L’infection profonde, ou abcès épidural. Elle survient en général de façon plus retardée, dans les jours ou semaines suivant la chirurgie. Elle se manifeste par un syndrome infectieux sévère (fièvre, asthénie), des douleurs cervicales et radiculaires et parfois des signes neurologiques (engourdissement, perte de sensibilité ou faiblesse musculaire). Une hospitalisation urgente est dans ce cas nécessaire. Une IRM du rachis cervical, sans et avec injection de produit de contraste ainsi qu’un bilan sanguin vous seront prescrits par votre chirurgien pour confirmer cette hypothèse diagnostique. Une reprise chirurgicale est nécessaire pour éradiquer le foyer infectieux par évacuation de l’abcès et lavage soigneux. Des prélèvements bactériologiques sont alors réalisés pour identifier le microbe responsable de l’infection et adapter le traitement antibiotique qui sera administré en urgence par voie veineuse puis par voie orale après disparition de la fièvre. En l’absence d’infection osseuse ou discale associée, un traitement de 1 mois est en général suffisant.
La plaie de dure-mère : également appelée brèche durale, ou durotomie accidentelle, elle survient classiquement dans 2 types de situation :
1) En cas de canal cervical très rétréci : dans ces cas, l’espace entre le fourreau dural et la paroi du canal est très réduit, et augmente le risque de brèche durale ;
2) En cas d’antécédent chirurgical au niveau opéré : l’adhérence cicatricielle importante des tissus entre eux (appelée fibrose post-opératoire) augmente là encore le risque de brèche durale pendant la chirurgie.
Des complications plus spécifiques de l’abord antérieur sont également décrites :
La paralysie récurrentielle : il s’agit d’une paralysie transitoire de la corde vocale liée à l’étirement du nerf récurrent qui l’innerve. Cela se traduit par une modification de la voix qui devient bitonale. La récupération se fait en quelques semaines, spontanément ou avec un peu de rééducation.
La dysphagie post-opératoire : il s’agit d’une gêne à la déglutition, liée à l’écartement nécessaire de l’oesophage et de la trachée pour exposer le rachis cervical. Naturellement, plus le geste à réaliser est long et difficile, plus la dysphagie risque d’être importante. Cette gêne est heureusement transitoire et la récupération peut-être accélérée par une courte corticothérapie (administration de cortisone) après l’intervention.
Résultats et évolution post-opératoire
Les résultats de cette chirurgie sont habituellement excellents. Dans la très grande majorité des cas l’évolution de votre maladie est arrêtée et si vos symptômes ne sont pas trop évolués ils peuvent régresser. Dans de rares cas, du fait de l’évolution des lésions dégénératives de votre colonne que l’on ne peut pas interrompre, les symptômes peuvent réapparaître au bout de quelques années ce qui peut faire éventuellement discuter une seconde intervention.
Votre lever sera en principe autorisé le lendemain de l’intervention, des médicaments vous seront administrés pour soulager vos douleurs, de la rééducation est souvent prescrite pour améliorer la qualité de votre état fonctionnel, la durée de séjour à l’hôpital est en règle générale inférieure à une semaine.



